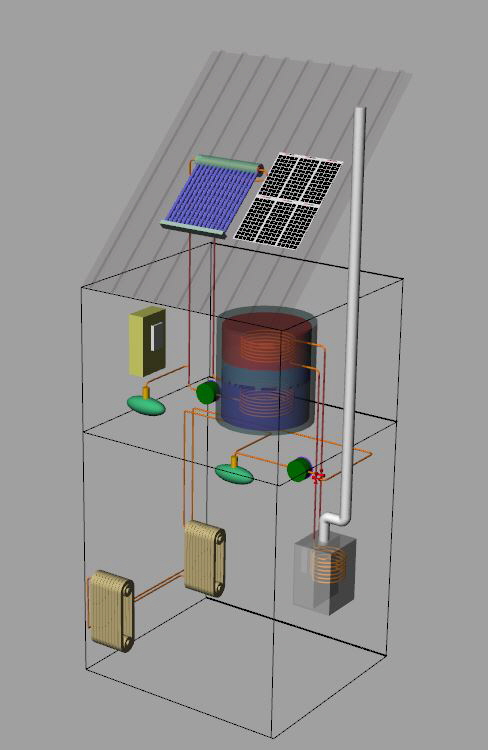
solare termico
Casa energeticamente autonoma
solarefotovoltaico
centralina di controllo
serbatoio di accumulo
caldaia
radiatori
All’inizio degli anni 90’, visitai la “casa solare” del centro atomico, “EURATOM”, in Ispra, in provincia di Varese.
Il calore del sole, con l’utilizzo di pannelli fotovoltaici e solari termici, rendevano l’abitazione energicamente autonoma; a detta dell’ingegnere, responsabile dell’impianto occorreva ricorrere alla energia esterna, per non più di tre giorni all’anno.
L’acqua calda per uso quotidiano era ottenuta da uno scambiatore di calore con un proprio serbatoio di capienza adeguata per le necessità giornaliere, mentre, sotto la villetta e grande quanto le fondamenta della casa stessa, c’era lo scambiatore per l’accumulo del calore solare; in pratica, una vasca colma d’acqua, riscaldata durante le giornate di sole.
Il calore accumulato nella vasca d’acqua era prelevata tramite scambiatore di calore e messa in circolo, utilizzando pompe per liquidi, che la facevano circolare nei tubi posti sotto il pavimento dell’abitazione in modo da garantire una temperatura confortevole per tutto l’anno solare.
L’energia per alimentare le pompe, le luci e gli elettrodomestici proveniva dai pannelli solari.
L’energia elettrica in eccesso era accumulata in alcune batterie al piombo, e riutilizzata, tramite un inverter capace di trasformare la tensione continua, in tensione alternata a 220 Volt e 50 Hertz di frequenza.
Oggi, per merito d’internet, e della facilità di reperimento e costruzione di dispositivi termoelettrici, è possibile sfruttare la differenza di calore tra la temperatura dell’acqua della vasca e la temperatura esterna, in modo da convertire l’energia termica accumulata, in energia elettrica; tra questi componenti ci sono le celle Peltier, che funzionano anche al contrario, sfruttando l’effetto Seebeck, e i motori a combustione esterna come il motore Stirling abbinato a un generatore di corrente.
Accumulare l’energia termica utilizzando il calore di dissoluzione delle sostanze chimiche necessita una grande capacità di stoccaggio.
La possibilità di utilizzare l’energia di dissolvimento di un sale nel suo solvente non è sempre fattibile a causa del rapporto costo/beneficio per piccoli impianti.
Un esempio di utilizzo dello sfruttamento commerciale delle reazioni esotermiche, lo abbiamo con
L’Acetato di Sodio
La cristallizzazione di una soluzione supersatura di Acetato di Sodio (CH3COO- Na+ ), è una reazione esotermica, conosciuta anche come “Hot Ice”, ed utilizzata per riscaldare le mani in inverno.
La soluzione satura del sale rimane liquida fintanto che evento esterno come un impulso meccanico, scatena la reazione di cristallizzazione con produzione di calore; facendo bollire la soluzione torbida e fredda, il composto ritorna allo stato liquido e limpido.
L’acetato di sodio può essere facilmente preparato in casa aggiungendo il bicarbonato di Sodio all’aceto.
Preparazione
In un recipiente contenente 1 litro di aceto (possibilmente aceto bianco) si aggiunge lentamente il bicarbonato di Sodio, finché non si sviluppano più bollicine di anidride carbonica CO2.
Na+[HCO3]- + CH3COO- H+ + H2O + CO2
Bollire, a fiamma bassa, finché la soluzione si concentra a circa 150-200cc millilitri, o meglio, finché si formano i primi cristalli.
Rimuovere dal fuoco e coprire il contenitore per evitare l’ulteriore precipitazione del acetato di Sodio.
Lasciar raffreddare e aggiungere una piccola quantità di acqua distillata, infine agitare per sciogliere i cristalli di acetato.
Mettere il tutto in frigorifero.
La soluzione ottenuta in questo modo è un esempio di “supecooled liquid”, dove il cristallo di acetato di sodio rimane in forma liquida.
L’equilibrio rimane stabile fintanto che un agente esterno induce l’inizio della cristallizzazione, con la produzione di calore.
Per innescare la cristallizzazione, è possibile aggiungere un piccolo cristallo di acetato di Sodio, oppure toccare la superfice con un dito, o, come nei sacchetti “scaldamano” acquistabili, introdurre nella confezione un meccanismo che innesca la reazione di cristallizzazione.
Se facendo bollire la soluzione, per utilizzare di nuovo lo “scalda mani”, la soluzione non ritorna limpida, significa che la reazione è stata innescata con l’aggiunta di piccoli cristalli di acetato di Sodio.
È possibile reperire sui siti di e-commerce, i cristalli di acetato di Sodio, già pronto.
Berkeley Lab, metodo “Ionocaloric cycle”
Una nuovo metodo in grado di conservare e rilasciare calore, applicando una piccola tensione che modifica la struttura molecolare; la fusione è una reazione endotermica che assorbe calore dall’ambiente, la solidificazione, rilascia il calore accumulato nell’ambiente.
il cambiamento di temperatura causato dal meccanismo ideato dal Berkeley Lab , con il nome di “Ionocaloric cycle”, sfrutta il flusso ionico proveniente dal materiale utilizzato come “fluido refrigerante”, che consiste in una soluzione salina di Iodio e Sodio, con l’aggiunta di carbonato di etilene ( https://en.wikipedia.org/wiki/Ethylene_carbonate ), comunemente utilizzato nelle batterie Li-ion.
Con una corrente a bassa tensione (meno di 1 volt), applicata alla soluzione salina, gli ioni, cambiano il punto di fusione, assorbendo calore dall’ambiente; invertendo il processo, gli ioni sono rimossi, il materiale solidifica, restituendo il calore accumulato.
gennaio 2023
 Riccardo Monti
Riccardo Monti